Alimento vivo – rotiferos e artemia
Alimento vivo em aquacultura
O sucesso da produção das fases larvares de várias espécies marinhas, tais como peixes, crustáceos e moluscos cefalópodes, ainda está muito dependente da utilização de alimento vivo (zooplâncton). Os organismos vulgarmente utilizados são os rotíferos (Brachionus spp.) e artémia (Artemia sp).
No caso dos rotíferos, são conhecidas mais de 1000 espécies, embora as espécies mais utilizadas em aquacultura pertençam ao género Brachionus. Com um tamanho variável entre 100 e 340 micrometros (comprimento da lórica, epiderme que envolve quase todo o corpo do rotífero), são normalmente o primeiro alimento oferecido quando as larvas de peixes marinhos abrem a boca. Em aquacultura é vulgar usar a denominação de rotíferos do tipo S ou L para diferenciar dois morfotipos. Duma forma simples, poderemos dizer que os rotíferos de tipo S são rotíferos de menores dimensões (100 – 210 micrometros) cuja extremidade da lórica tem um aspecto espinhoso pontiagudo e os rotíferos de tipo L de maiores dimensões (100 – 340 micrometros) com a extremidade da lórica de aspecto espinhoso mais rombo.
Apesar de os Brachionus spp. tolerarem grandes amplitudes salinas e térmicas, em aquacultura os rotíferos são mantidos em ambientes controlados de condições favoráveis a uma reprodução assexuada por partenogénese. Por exemplo, a uma temperatura de 25°C uma fêmea pode reproduzir-se aproximadamente a cada 4 h e cada nova fêmea reproduzir-se após cerca de um dia e meio.
 1. |
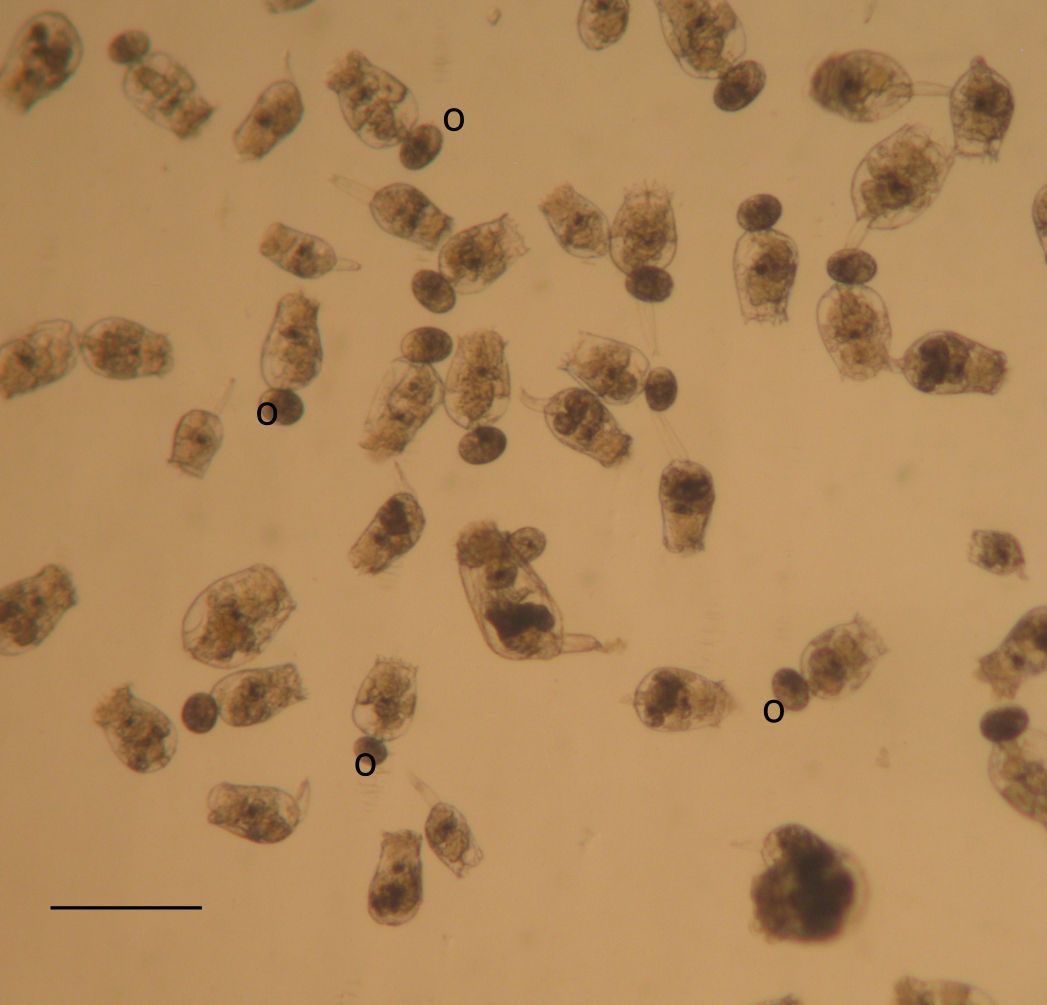 2. |
Figura 1 – Morfologia de rotiferos do tipo L e S e respectivas dimensões;
Figura 2 – Rotiferos cultivados na EPPO; alguns exemplares apresentam 1 ovo amíctico (o) na parte inferior, podendo atingir até 3 ovos. O número de ovos permite estimar o crescimento da população; barra = 300 micrometros.
As artémias, possuem um tamanho superior ao dos rotíferos, e constituem normalmente o segundo e último alimento vivo fornecido às larvas de peixes antes da adaptação ao alimento inerte. Ao contrário dos rotíferos estes organismos são cultivados a partir de cistos (ovos de resistência) adquiridos comercialmente. Estes cistos são incubados nas condições mais favoráveis à sua eclosão (temperatura entre 25 e 28°C; iluminação de 2000 lux por um período mínimo de 6h, arejamento forte para evitar a deposição dos cistos no fundo e salinidade a 27) e após cerca de 24h recolhem-se os organismos eclodidos, nauplios instar I (430 micrometros). As reservas endógenas do nauplio são utilizadas pelo próprio organismo para se desenvolver, atingindo a fase nauplio instar II de maiores dimensões (520 micrometros) nas seguintes 24h (20-24°C). A fase instar I apresenta um perfil nutricional fixo, isto é, não pode ser manipulado, ao contrário da fase instar II, e seguintes, as quais já se alimentam. O perfil nutricional dos nauplios também varia com a origem dos cistos, marinha - normalmente um perfil nutricional mais rico em ácido gordos altamente insaturados (essenciais para o desenvolvimento das larvas); e continental – com um perfil nutricional mais pobre em ácidos gordos polinsaturados. Normalmente em aquacultura utilizam-se os nauplios Instar I de cistos de origem marinha, e nauplios Instar II e III de cistos de artemia continental, os quais são enriquecidos com emulsões comerciais.
 |
 |
 |
 |
Figura 3 – Diversas fases do ciclo de vida da Artemia spp; A – cistos de artémia e recém-eclodida; B – nauplios de artémia com cerca de 3 horas (instar I); C – instar I e instar II; D – artemia (instarII) enriquecida com emulsão lipidica de cor vermelha. Barra = 200 micrometros
Apesar de não serem o alimento preferencial destas espécies na natureza os rotíferos e as artémias, possuem um conjunto de características que os torna os organismos ideais para serem produzidos em aquacultura marinha: 1 – fáceis de cultivar, podendo ser produzidos e mantidos em densidades elevadas; 2 – é fácil e rápido aumentar a produção: no caso dos rotíferos, por terem um ciclo de vida curto; no caso da artémia por se utilizarem cistos (ovos) desidratados e conservados, os quais são colocados em água salgada para eclodirem; 3 – pequenas dimensões (0,1 a 0,5 mm) adequadas ao pequeno tamanho da boca das larvas; 4 – velocidade de locomoção adequada à fraca locomoção das larvas; 5 - são filtradores não selectivos, ou seja, alimentam-se de todo o tipo de partículas com dimensões adequadas, podendo o seu perfil nutricional ser manipulado para o adequar às necessidades das larvas.
 |
 |
 |
 |
 |
 |
Figura 4 – Na alimentação das fases larvares de peixes marinhos é importante adequar o tamanho da presa à dimensões da boca da larva, independentemente dos dias de vida. Larvas de corvina 4 DAE (A) e de sardinha 9 DAE (B) alimentadas com rotiferos. Com o desenvolvimento das larvas, os rotiferos são gradualmente subsituidos pela artémia. Larvas de corvina com 10 DAE (C) e de sardinha com 27 DAE (E), alimentadas com nauplios de artémia. Em ambas as espécies é evidente a presença de alimento no tracto digestivo (D e F). DAE- dias após a eclosão; barra = 1 mm.
Investigação na EPPO
No IPMA, o cultivo do alimento vivo remonta a meados dos anos 80, em paralelo com o início da investigação em larvas de peixes marinhos (ver dourada, robalo e linguado). Inicialmente foi necessário definir as melhores condições de produção, para optimizar a taxa de eclosão dos cistos e as taxas de sobrevivência dos nauplios, tais como temperatura, fotoperíodo, oxigénio, os melhores alimentos, entre outros. Apesar do conhecimento gerado, do desenvolvimento de novas tecnologias e da produção de novas espécies de peixe em aquacultura, a investigação nesta área continua a ter grande interesse. O IPMA tem centrado a sua investigação na optimização de protocolos de acondicionamento do alimento vivo a baixa temperatura, para preservar o perfil nutricional lipídico durante um maior período, e, na definição de protocolos alimentares adequados a cada fase do desenvolvimento de espécies marinhas com potencial de produção em aquacultura (ex: sardinha, corvina e sargo), nomeadamente quando e em que quantidade se pode fornecer cada alimento vivo. Para além disso, grande parte da investigação do IPMA nesta área tem sido feita para apoiar o sector privado no desenvolvimento de novos produtos: 1 – novas formulações para enriquecimento e/ou produção de rotíferos e artémia e seu efeito no desenvolvimento larvar de novas espécies de peixes marinhos produzidos em aquacultura (nomeadamente a corvina); 2 - utilização de macroalga como possível controlador microbiano; 3 - utilização de organismos alternativos aos rotíferos e artémia, nomeadamente copépodes, produzidos no IPMA (Acartia grani) e outros organismos fornecidos pelo sector privado em diferentes estados de conservação. Estes ensaios foram realizados em colaboração com a Universidade do Algarve e com as seguintes empresas: BERNAQUA, NV , SPAROS I&D, NECTON S.A., PLANKTONIC, SA.